پلیمریزاسیون متالوسنی، در حال ایجاد یک تحول عظیم، در صنعت پلاستیک است. چرا که از زمان ابداع پلیمریزاسیون زیگلر-ناتا تا کنون، بهترین روش برای تولید پلیمرهای وینیلی محسوب میشود. علت این همه هیاهو دربارهی این موضوع چیست؟ دلیل این است که پلیمریزاسیون کاتالیزوری متالوسن، ما را قادر به ساخت پلیاتیلنی میکند که میتواند گلولهها را متوقف کند! این پلیاتیلن جدید برای ساخت جلیقههای ضد گلوله، بهتر از کولار عمل میکند. دلیل داشتن چنین قابلیتی، وزن مولکولی بسیار بالاتر آن، نسبت به پلیاتیلن ساخته شده از طریق روش زیگلر- ناتا است. چقدر بالا؟ تا شش یا هفت میلیون!
البته مسئله، تنها وزنهای مولکولی بالا نیست. پلیمریزاسیون متالوسنی، برای ساخت پلیمرهایی با تاکتیسیتهی معین نیز مناسب است. این پلیمریزاسیون میتواند، طبق نیاز و خواستهی شما، برای ساخت پلیمرهای ایزوتاکتیک و سیندیوتاکتیک، تنظیم شود.
پلیمریزاسیون متالوسنی، پلیمریزاسیونی است که به وسیلهی متالوسنها کاتالیز میشود. یک متالوسن، یک یون فلزی با بار مثبت است که بین دو آنیون سیکلوپنتادیانیل با بار منفی، ساندویچ شده است. آنیون سیکلوپنتادیانیل، یون فعال کوچکی است که از مولکول کوچکی به نام سیکلوپنتادیان ساخته شده است:
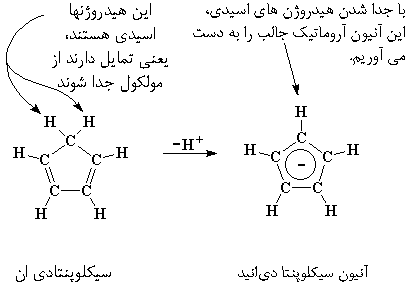
ممکن است توجه کرده باشید که در مولکول سیکلوپنتادیان اکثر اتمهای کربن یک هیدروژن دارند، اما یک اتم کربن دارای ۲ هیدروژن است. یکی از این دو هیدروژن، اسیدی است، یعنی به راحتی قابل جدا شدن است. وقتی این اتفاق بیافتد، این اتم الکترونهای پیوندی خود را، یعنی یک زوج الکترون، بر جای میگذارد. بنابراین کربنی که هیدروژن از آن جدا میشود، اکنون فقط یک هیدروژن دارد، درست مثل بقیه، با این تفاوت که دارای یک زوج الکترون اضافی نیز میباشد.
آن دو پیوند دوگانه را در مولکول میبینید؟ هر یک از آنها دو الکترون دارد، و در مجموع، چهار الکترون داریم. دو الکترون اضافی هم، روی کربنی است که هیدروژن از دست داده بود. اگر آنها را هم به این چهار الکترون اضافه کنید، در نهایت شش الکترون خواهیم داشت.
این مطلب، مهم است. شش الکترون در یک مولکول حلقوی، مثل این مولکول، حلقه را آروماتیک میکند و حلقه در این شکل آنیونی، بسیار پایدار خواهد بود.
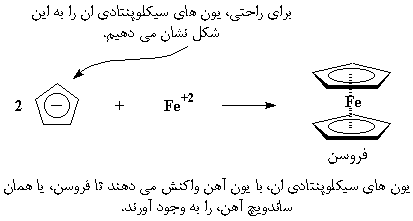
این یون های سیکلوپنتادی ان، بار ۱- دارند، بنابراین هنگامی که یک کاتیون، مثل Fe با بار ۲+ وارد می شود، دو تا از این آنیون ها یک ساندویچ آهن درست خواهند کرد. این ساندویچ آهن، فِروسن نامیده می شود.
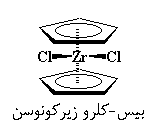
گاهی اوقات، فلزی با بار بیشتر، مانند زیرکونیم با بار ۴+، وارد کار میشود. برای موازنهی بار، زیرکونیم با دو یون کلراید که هر یک بار ۱- دارند، پیوند برقرار میکند تا یک ترکیب خنثی به دست آید.
زیرکونوسنها کمی با فروسنها تفاوت دارند. همان طور که میبینید، لیگاندهای اضافی، یعنی کلرها، فضا را اشغال میکنند و برایشان سخت است که بین حلقههای سیکلوپنتادیانیل فشرده شوند. به منظور ایجاد فضا برای کلرها، حلقهها از حالت موازی قبلی، کمی منحرف میشوند و مثل یک پوستهی صدف باز میشوند. این عمل، به کلرها فضای نفس کشیدن میدهد. نگاهی به تصویر زیر بیندازید:
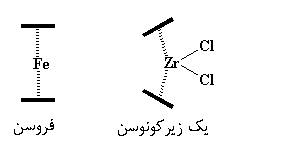
همانطور که میبینید، حلقههای سیکلوپنتادیان، که به صورت خطهای ضخیم تیره نشان داده شدهاند، در فروسن با هم موازی هستند، اما در زیرکونوسن با هم زاویه میسازند. این انحراف هر گاه که یک متالوسن لیگاندهایی بیش از دو حلقهی سیکلوپنتادیان داشته باشد، رخ میدهد.
ما میتوانیم از برخی مشتقات بیس-کلرو زیرکونوسن برای ساخت پلیمرها استفاده کنیم. مثلاً این یکی را در نظر بگیرید:
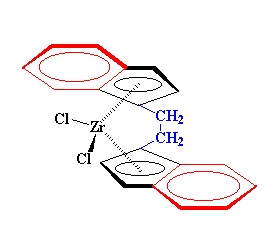
مادهی فوق با بیس-کلرو زیرکونوسن، کمی تفاوت دارد؛ زیرا هر حلقهی سیکلوپنتادیان، یک حلقهی آروماتیک شش کربنی دارد که به آن چسبیده است، و در شکل با رنگ قرمز نشان داده شده است. این سیستم دو حلقهای که از ترکیب یک حلقهی سیکلوپنتادیان، با یک حلقهی فنیلی ساخته شده، لیگاند ایندِنیل نامیده میشود. به علاوه، یک پُل اتیلنی هم وجود دارد ،که با رنگ آبی ترسیم شده است، و حلقههای سیکلوپنتادیان بالایی و پایینی را به هم متصل میکند. این دو ویژگی، سبب میشود که این ماده کاتالیزور بسیار خوبی برای ساخت پلیمرهای ایزوتاکتیک باشد. همانطور که میبینید، لیگاندهای حجیم و بزرگ ایندنیل، که در جهتهای مخالف هم قرار گرفتهاند، مونومرهای ورودی را هدایت میکنند. این هدایت موجب میشود که مونومرها فقط در جهت از پیش تعیین شده واکنش دهند تا پلیمرهایی ایزوتاکتیک تولید کنند. پل اتیلنی، دو حلقهی ایندنیل را در جای خودش نگه میدارد. بدون این پل، حلقهها میتوانند تا حدی بچرخند و دیگر ممکن نیست که در جهت مناسب بمانند و واکنش پلیمریزاسیون ایزوتاکتیک را راهنمایی کنند.
پلیمریزاسیون
تا اینجا، درباره ی اینکه متالوسن ها چه هستند، و اینکه چرا می توانند پلیمرهایی با نظم فضایی معین بسازند، صحبت کردیم. اما درباره ی این موضوع حرفی نزدیم، که این پلیمریزاسیون واقعاً چگونه رخ می دهد. برای این که کمپلکس زیرکونوسن را وادار کنیم که پلیمریزاسیون را کاتالیز کند، نخست باید کمی از ماده ای به نام MAO که مخفف متیل آلوموکسان است به آن اضافه کنیم. خود MAO، پلیمری با ساختاری شبیه به این است:
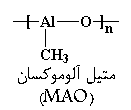
این ماده، پلیمری غیرعادی است، زیرا در زنجیر اصلی خود، اتم های فلزی دارد. برای به کار انداختن کاتالیزور، باید از مقدار قابل توجهی، یعنی حدود ۱۰۰۰ برابر مقدار کاتالیزور، MAO استفاده کنیم.
MAO برکلرهای زیرکونوسن، اثر می گذارد. این کلرها ناپایدار هستند و دوست دارند که از زیرکونوسن جدا شوند. بنابراین می تواند آنها را با تعدادی از گروه های متیل خود، جایگزین کند. در نهایت کاتالیزوری که برای ما به جا می ماند به شکل زیر خواهد بود:
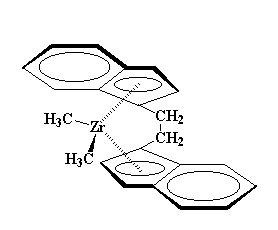
گروههای متیل هم میتوانند جدا شوند. وقتی که یکی از آنها جدا شود، کمپلکسی شبیه به این، به دست میآوریم:

با توجه به شکل، در می یابید که زیرکونیم دارای بار مثبت، به خاطر الکترون های پیوند کربن-هیدروژن که با زیرکونیم به اشتراک گذاشته شده است، پایدار گردیده است. این پدیده تجمع
a-آگوستیک نامیده می شود. اما هنوز هم زیرکونیم، کمبود الکترون دارد. این اتم به چیزی بیش از یک تجمع آگوستیک ضعیف نیاز دارد. اینجاست که مونومر اولفین ما وارد عمل می شود. آلکنی مثل پروپیلن را تصور کنید، پیوند دوگانه ی کربن-کربن آن، توسط الکترون های اشتراکی، غنی است. بنابراین پیوند دوگانه، یک زوج الکترون را با زیرکونیم به اشتراک می گذارد، و حداقل برای لحظاتی، همه راضی خواهند بود.
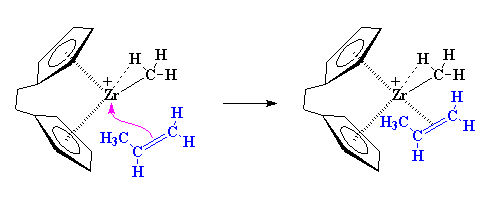
با این حال، کمپلکس شدن، فرآیند نسبتاً پیچیدهای است، و به سادگی آنچه این شکل نشان میدهد، نیست. اگر از قبل میدانید که فرآیند کمپلکس شدن به چه ترتیبی است، لازم نیست به سراغ بخش بعدی بروید، و میتوانید مستقیماً به بخش پلیمریزاسیون وارد شوید. ولی اگر این طور نیست، مطالعهی این صفحه را به همین ترتیب ادامه بدهید تا بفهمید که کمپلکس شدن چگونه عمل میکند.
درباره کمپلکس شدن آلکن-فلز بیاموزید
ورود مستقیم به پلیمریزاسیون
کمپلکسهای آلکن-فلز
اکنون یک مونومر وینیلی، مثلاً یک مولکول پروپیلن را در نظر بگیرید. زیرکونیم قصد دارد از حضور این مونومر استفاده کند. برای فهمیدن دلیل این امر، بیایید به مونومر وینیلی، مخصوصاً به پیوند دوگانه ی آن، نگاهی بیاندازیم. یک پیوند دوگانه ی کربن-کربن، از یک پیوند σ و یک پیوند π تشکیل شده است. قصد داریم نگاهی دقیق تر به پیوند π داشته باشیم.
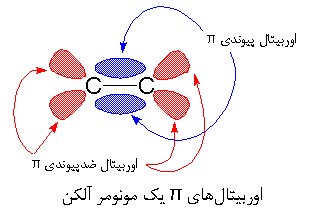
اگر نگاهی به شکل بالا بیندازید، خواهید دید که پیوند π، شامل دو اوربیتال π است؛ یکی اوربیتال پیوندی π (به رنگ آبی) و دیگری اوربیتال ضد پیوندی π (به رنگ قرمز). اوربیتال پیوندی، دو لُب دارد که بین اتم های کربن هستند، و اوربیتال ضد پیوندی، دارای چهار لب است که به سمت خارج از اتم های کربن قرار گرفته اند. معمولاً زوج الکترون ها داخل اوربیتال پیوندی می مانند. اوربیتال ضد پیوندی از نظر انرژی در سطح بالایی است، و بدین ترتیب در شرایط عادی خالی می ماند.
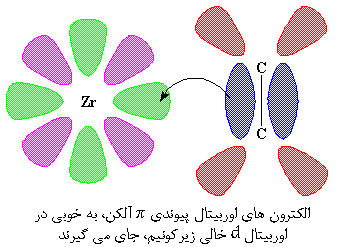
دوباره به زیرکونیم نگاه کنیم. این شکل زیرکونیم و دو اوربیتال d آن را نشان می دهد. اکنون برای اطمینان، یادآوری می کنیم که زیرکونیم پنج اوربیتال d دارد که ما برای راحتی و وضوح، دو تا از آنها را نشان می دهیم.

یکی از اوربیتال های d که ما نشان داده ایم، اوربیتال خالی و به رنگ سبز است. لب های صورتی، یکی از اوربیتال های پر d هستند. آن اوربیتال خالی d به دنبال یک زوج الکترون می گردد، و می داند آن را در کجا جستجو کند. این اوربیتال می داند که اوربیتال پیوندی π آلکن، یک زوج الکترون دارد که می تواند آن را به اشتراک گذارد. بنابراین اوربیتال پیوندی π آلکن و اربیتال d زیرکونیم به هم نزدیک می شوند و یک زوج الکترون به اشتراک می گذارند.
اما به محض اینکه این دو به هم می رسند، اوربیتال d دیگر هم، بسیار به اوربیتال خالی ضد پیوندی π نزدیک می شود. بنابراین اوربیتال d و اوربیتال ضد پیوندی π نیز یک زوج الکترون به اشتراک می گذارند.
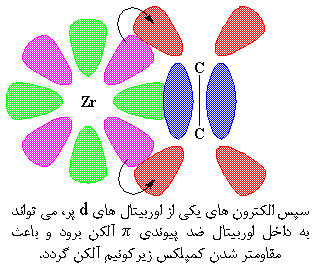
این اشتراک اضافی الکترونها، کمپلکس را مقاومتر میکند. کمپلکس شدن بین آلکن و زیرکونیم، همه چیز را برای مرحله ی بعدی که پلیمریزاسیون است، آماده میکند.
پلیمریزاسیون
ماهیت دقیق کمپلکس بین زیرکونیم و پروپیلن، پیچیده است. بنابراین برای سادهسازی، ما این کمپلکس را به همان صورت قبلی رسم میکنیم، یعنی به این شکل:
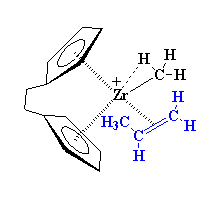
کمپلکس شدن، زیرکونیم را پایدار میکند، اما این پایداری زیاد طول نمیکشد. هنگامی که این کمپلکس تشکیل میشود، میتواند خود را به شکلی جدید، نوآرایی کند. همان طور که در شکل زیر میبینید، الکترونها شروع به حرکت میکنند. الکترونهای پیوند زیرکونیم و کربن متیل، جابهجا میشوند تا پیوندی بین کربن متیل و یکی از کربنهای پروپیلن برقرار کنند. در این بین، زوج الکترونی که کمپلکس آلکن-فلز را تشکیل داده بود، جابهجا میشود تا یک پیوند کامل را بین زیرکونیم و یکی از کربنهای پروپیلن به وجود آورد.
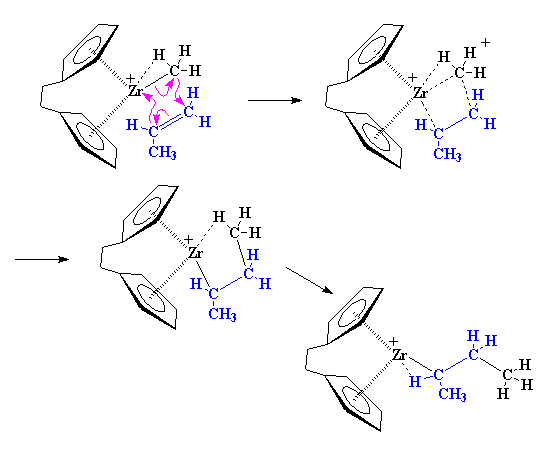
همانطور که در تصویر مشاهده می کنید، این انتقال ها در یک حالت گذار چهار مرحلهای صورت می گیرد. همچنین، ملاحظه می کنید که زیرکونیم سرانجام به همان صورتی در می آید که کار را شروع کرده بود، یعنی دچار کمبود یک لیگاند است، و در عین حال یک تجمع α-آگوستیک، با پیوند C-H از مونومر پروپیلن برقرار کرده است.
اگر به ابتدای بحث برگردیم، مشاهده میکنیم که یک مونومر پروپیلن دیگر میتواند وارد شود و درست مثل مونومر اول، واکنش دهد.
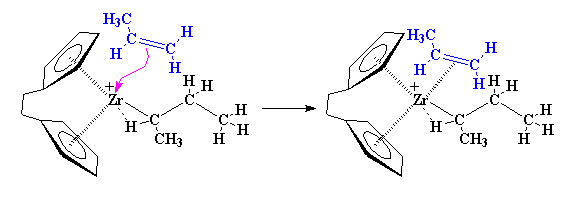
پروپیلن با زیرکونیم، پیوند دوگانه تشکیل میدهد … سپس الکترونها جابجا میشوند:
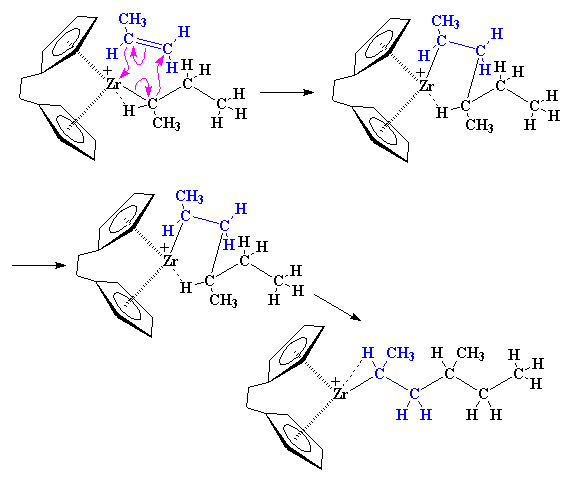
وقتی این عمل به پایان رسد، مونومر پروپیلن دوم به زنجیر افزوده شده است. توجه کنید که ما در پایان یک پلیمر ایزوتاکتیک داریم، یعنی گروههای متیل همواره در یک طرف زنجیر پلیمری هستند. همانگونه که احتمالاً پیشبینی کردهاید، مونومر بعدی در همان طرفی که مونومر اول بود، با زیرکونیم پیوند تشکیل میدهد. به عبارت دیگر، جهتی که مونومر به زیرکونیم نزدیک میشود، با اضافه شدن هر مونومر، عوض میشود.
اما چرا پلیمری ایزوتاکتیک به دست میآوریم؟ کمی به کاتالیزور و مونومر پروپلین ورودی دقت کنید. همانطور که میبینید، همواره مونومر پروپیلن به گونهای به کاتالیزور نزدیک میشود که گروه متیل، از لیگاند ایندنیل دور باشد.
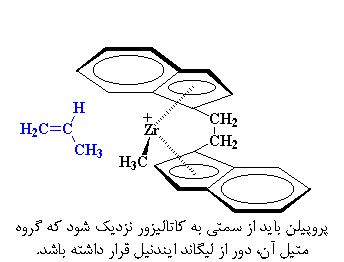
اگر گروه متیل در موقعیت نزدیک به لیگاند ایندنیل قرار گیرد، دو گروه به یکدیگر نیرو وارد میکنند و به پروپیلن اجازه نمیدهند که به اندازهی کافی به زیرکونیم نزدیک شود و کمپلکس تشکیل دهد. از این رو، فقط هنگامی که گروه متیل، دور از لیگاند ایندنیل باشد، پروپیلن میتواند با زیرکونیم کمپلکس شود.
هنگامی که مونومر دوم اضافه میشود، ناچار است از سمت دیگر نزدیک شود، و همچنین مجبور است گروه متیل خود را دور از حلقهی ایندنیل قرار دهد:
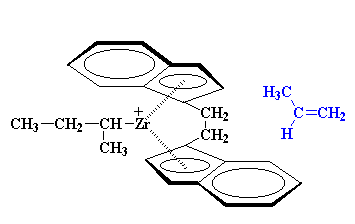
اما توجه داشته باشید که این مطلب، به معنی این است که جهت گروه متیل به سمت بالاست، نه پایین. از آنجاییکه پروپیلن دوم، در جهت مخالف مونومر اول در حال اضافه شدن است، باید در خلاف جهت آن قرار بگیرد تا گروههای متیل نهایتاً، همگی در یک طرف زنجیر پلیمر باشند.
اینجا یک سؤال ممکن است پیش آید. فهمیدیم که این کاتالیزور، پلیپروپیلن ایزوتاکتیک تولید میکند، ولی چه نوع کاتالیزوری به ما پلیپروپیلن سیندیوتاکتیک خواهد داد؟
کاتالیزوری مثل شکل زیر، که از سوی Ewen و Asanuma مورد مطالعه قرار گرفت، چنین کاری را برای ما انجام می دهد.
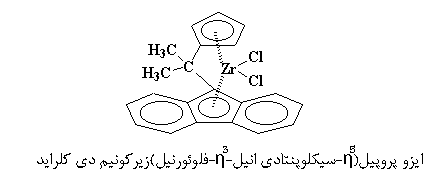
فکر میکنم بتوانید بفهمید که چرا از این کاتالیزور، پلیمر سیندیوتاکتیک به دست میآوریم. مونومرهای پیدرپی، از سمت مخالف هم به کاتالیزور نزدیک میشوند، اما همواره گروههای متیل خود را به سمت بالا قرار خواهند داد. به همین ترتیب، گروههای متیل تا انتهای کار، به طور متناوب، در بالا و پایین زنجیر پلیمر قرار خواهند گرفت.
بحران هویت
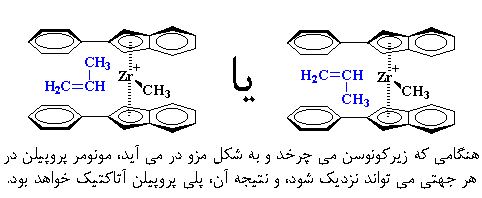
با این حال، کاتالیزورهای متالوسن، میتوانند کارهای عجیبتر از این هم انجام دهند. بیایید بیس(۲-فنیلایندنیل)زیرکونیمکلراید را در نظر بگیریم. این متالوسن، همان گونه که در زیر میبینید، هیچ پلی بین دو حلقهی ایندنیل ندارد.
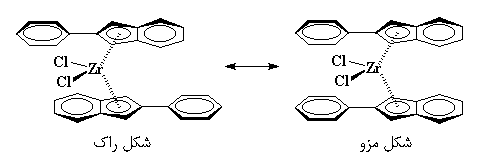
به عبارت دیگر، دو حلقه میتوانند آزادانه بچرخند. گاهی اوقات حلقهها در جهت مخالف هم قرار میگیرند، که ما این حالت را شکل راک مینامیم. در مواقع دیگر، حلقهها در یک سمت قرار میگیرند که ما به آن شکل مِزو میگوییم. ترکیب، مدتی به شکل راک است، سپس میچرخد و به شکل مزو در میآید. پس از مدتی دوباره میچرخد و به حالت اولیه بر میگردد، و این چرخیدن مرتباً و پشت سرهم تکرار میشود.
خب، این مطلب برای پلیمریزاسیون چه کاربردی دارد؟ کاربرد آن عجیب است. هنگامی که زیرکونوسن در شکل راک است، مونومرهای پروپیلن فقط میتوانند در جهتی نزدیک شوند که پلیپروپیلن ایزوتاکتیک بدهد.
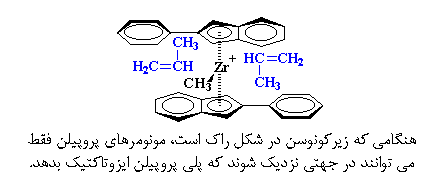
اما هنگامی که زیرکونیم میچرخد و به شکل مزو در میآید، مونومر پروپیلن در هر جهتی میتواند نزدیک شود و نتیجهی آن، پلیپروپیلن آتاکتیک خواهد بود.
به خاطر داشته باشید که زیرکونوسن، دائماً در حال تغییر شکل، بین دو حالت خود میباشد، و این کار را حتی در حین انجام پلیمریزاسیون هم تکرار میکند. این مطلب، بدان معنی است که پلیمریزاسیون در حالی به پایان میرسد که یک زنجیر پلیمری، قطعههایی به صورت آتاکتیک، و قطعههایی به شکل ایزوتاکتیک دارد. مثل این:
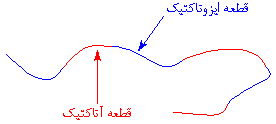
این نوع از پلیپروپیلن، پلیپروپیلن الاستومری نامیده میشود، زیرا واقعاً، همین طور است، و یک الاستومر است. اما فقط این نیست. این پلیمر، نوع خاصی از الاستومر است که الاستومر گرمانرم نامیده میشود. برای اینکه بدانید چرا این نوع خاص از پلیپروپیلن به عنوان یک الاستومر عمل میکند، صفحهی پلیپروپیلن و صفحهی الاستومر گرمانرم را ببینید!
 my
my
بسیار جالب وروان بیان شده .سپاس فراوان
جناب حسن زاده . خیلی ممنونم بابت لطفی که داشتید برای گردآوری این مطلب